La Enfermedad Vírica Hemorrágica (RHD) del conejo es una enfermedad causada por un calicivirus, extremadamente contagiosa y a menudo mortal de los conejos domésticos y silvestres. Solo afecta al conejo europeo (Oryctalagus cuniculus).
Fue descrita a comienzos de 1984 en la provincia de Jiangsu, en la parte suroriental de China. En los primeros casos descritos, el origen de la enfermedad fue atribuido a un grupo de conejos de raza Angora procedentes de la entonces República Federal de Alemania.
A finales de la década de los 80 aparecieron en España los primeros brotes de la enfermedad, causando un gran descenso en la población de conejos, tanto silvestres como domésticos.
El desarrollo de vacunas inactivadas, unido a la poca variabilidad antigénica del virus, permitió controlar la enfermedad hasta el año 2011, cuando empezaron a detectarse casos “atipicos” en España, en Navarra, Aragón y Cataluña.
La vacuna comercializada hasta la fecha no proporcionaba inmunidad y los mayores índices de mortalidad se producían en gazapos menores de 50 días, un rango de edad en el que, según lo que se sabía, los conejos no eran susceptibles al virus. Se trataba de una nueva variante del virus, genética y antigénicamente distinta al virus clásico.
Etiología
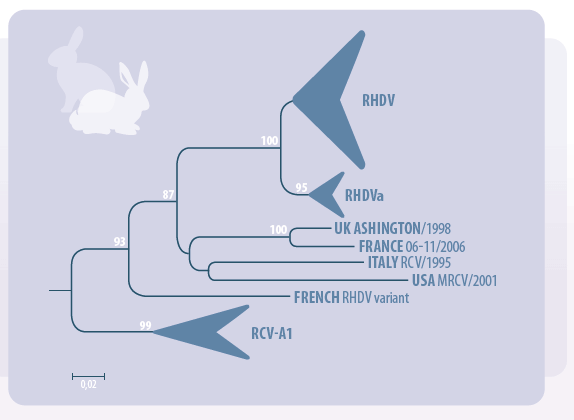
La RHD está causada por el Virus de la Enfermedad Hemorrágica del Conejo (RHVD), un miembro del genero Lagovirus y de la familia Caliciviridae. Parece que circulan muchas cepas entre las poblaciones, y estos virus pueden tener diferentes características epidemiológicas y genéticas entre ellas.
Únicamente se conoce un serotipo, pero existen dos subtipos principales: el RHVD y la variante antigénica RHVDa, habiéndose identificado cepas no patogénicas del RHVD circulando en conejos silvestres. Fue en el año 2010 cuando se ha detectado por primera vez en Francia una nueva variante antigénica del virus, denominada RHD2.
En los tejidos de los conejos infectados es posible evidenciar al microscopio electrónico un virus privado de envoltura, icosaédrico y con un diámetro promedio de 32 nm (varia entre 28 y 36 nm).
En muestras bien purificadas se puede apreciar en la superficie del virus la presencia de depresiones caliciformes regularmente distanciadas, que rodean al virión. La mayor parte de los viriones presentan un núcleo hexagonal de diámetro medio de 21nm, impermeable a los electrones, aunque en muchos casos se presenta electrotransparente.
El virus posee una sola proteína estructural principal, cuyo peso molecular es aproximadamente de 60kd, y por ese motivo se le conoce como VP60; la proteina viral de 60 kd de peso es una de las proteínas más importantes para la lucha vacunal. Esta proteína estructural es muy similar a la descrita para el calicivirus felino, que reacciona de manera especifica con sueros inmunes e hiperinmunes antiRHVD.
El ácido nucleico es una cadena RNA de hélice sencilla con polaridad positiva, y el virus es capaz de aglutinar los glóbulos rojos humanos de tipo 0. Por ello, fue una de las técnicas descritas para diagnóstico de la presencia de virus en conejos afectados. Esta cadena ARN tiene un coeficiente de sedimentación de 152S y una densidad a la ultracentrifugación, usando gradiente al cloro de cesio, que oscila 1,36 y 139 g/ml, siendo muy resistente al éter y al cloroformo.
Hasta el momento, el virus no puede ser cultivado “in vitro” y han fallado los experimentos para identificar substratos celulares sensibles y condiciones de cultivos celulares apropiadas para una replicación productiva del virus.
Si se excluye al conejo domestico y al silvestre, de momento no parece que otras especies sean receptivas a la infección. En lo referente a la liebre, ésta es considerada receptiva, pero no debemos olvidar que en esta especie, aún antes de que apareciera en Europa la RHD, se habían observado episodios de una patología denominada “European Brown Hare Syndrome”-EBHS- muy similar a la RHD en caracteres etiológicos, clínicos, epidemiológicos y anatomopatológicos.
De cualquier modo, el virus de la EBHS, si bien morfológicamente es similar al de la RHVD, presenta características antigénicas y bioquímicas que, aún confirmando una cierta correlación entre los dos agentes, los diferencia sustancialmente.
Vistas las semejanzas existentes entre RHD y EBHS, la Oficina Internacional de Epizootías -OIE- reunió las dos patologías bajo la denominación de “Complejo Enfermedad Hemorrágica Viral de los Lagomorfos”.
Epidemología
Factores dependientes del hospedador
El conejo, doméstico o silvestre, parece ser la única especie naturalmente receptiva al virus de la Enfermedad Vírica Hemorrágica (RHD). Ha sido posible reproducir la enfermedad en la liebre mediante la inoculación de material patológico recogido de conejos muertos por RHD natural. Sin embargo, la inoculación de homogeneizados de órganos de conejos muertos no es capaz de causar enfermedad en cobayas, hámsters, ratas, embriones de pollo, cerdos ni ovejas.
La enfermedad no distingue estados fisiológicos, los primeros animales afectados son las futuras reproductoras de 2,5 a 4,5 meses. En segundo lugar, las conejas en producción, a continuación los gazapos de más de 60 días, y por ultimo, los machos adultos y en menor grado los jóvenes.
En general, los animales de edad inferior a 6 semanas resultan refractarios al RHVD. A su vez, hay cierta resistencia natural en ciertos animales adultos y en gazapos menores de dos meses.
Hay que destacar del virus RHVD2 (nueva variante) la susceptibilidad que presentan los animales jóvenes, observándose sintomatología en gazapos menores de 50 días. Los animales adultos también son susceptibles a la nueva variante, pero con menor mortalidad.
En 2011 empezaron a detectarse casos “atípicos” de RHD en distintas explotaciones del noreste peninsular. En los 2 años posteriores siguieron apareciendo nuevos casos y el RHD2 se fue diseminando por toda España.
Factores dependientes del medio ambiente
Como factores predisponentes conviene reseñar el estrés térmico y la localización de las bajas con respecto a los sistemas de ventilación. Las granjas con malas condiciones sanitarias y de manejo están más predispuestas a padecer la enfermedad.
Factores dependientes del microorganismo
El RHVD es muy resistente a la inactivación cuando se encuentra protegido dentro de los tejidos. Este virus puede sobrevivir hasta 7 meses y medio en suspensiones de tejidos conservados a 4º C, y más de 3 meses a 20ºC en órganos secos, lo que hace que sea un virus con alta permanencia en las instalaciones.
La infectividad del virus no se reduce mediante tratamiento con éter, cloroformo, exposición a pH 3 o calentamiento a 50ºC, y sobrevive a los ciclos de congelación-descongelación.
El virus es inactivado por hidróxido de sodio al 1%, por formol al 0,4% a temperatura ambiente y por betapropiolactona al 0,2% o al 0,5%.
Contagio
El conejo silvestre es el principal difusor de la RHD, sin exclusión de vectores o mecanismos de contagio. La promiscuidad de animales domésticos con los conejos silvestres o la afluencia de pájaros, ratones o insectos, también están relacionados.
El contagio por contacto es el responsable del afincamiento de la enfermedad en una granja, siendo la vía aerógena suficiente para su difusión, y no se pueden descartar otras como la oral, conjuntival o las heridas en piel y mucosas.
Se cree que la mayoría de las excreciones, o todas, incluidas la orina, las heces y las secreciones respiratorias, contienen el virus. Los animales pueden permanecer infectados hasta un mes, pudiéndose también infectarse por contacto con un cadáver o el pelo de un animal infectado.
Los animales silvestres pueden transmitir el virus mecánicamente: los predadores o carroñeros pueden excretar el RHDV en las heces después de comer conejos infectados.
Tasas de morbilidad y mortalidad
El índice de morbilidad varía del 30 % al 100 %, siendo el índice de mortalidad muy elevado y raramente inferior al 60%.
La mortalidad en los reproductores de las granjas sin vacunar puede llegar a alcanzar el 90% en conejas y un 70% en los machos. En cuestión de una semana la granja queda diezmada. La mortalidad hasta los 65 días es normal y prácticamente nula en los gazapos presentes en los nidos.
Los gazapos lactantes pueden sobrevivir con alimentación granulada después de que la madre muera, siempre y cuando ya tengan la edad mínima necesaria y los supervivientes – entre un 4% y un 20% – no presentan ningún síntoma.
La mortalidad en el caso de RHDV2 es muy variable abarcando un amplio espectro entre el 5 y el 70%.
Presentación
Las épocas en que se presenta son principalmente primavera y otoño. La difusión de la enfermedad es muy errática. Se ha detectado en provincias distantes sin ningún nexo de unión aparente.